「真実を見つめる」2004年8月
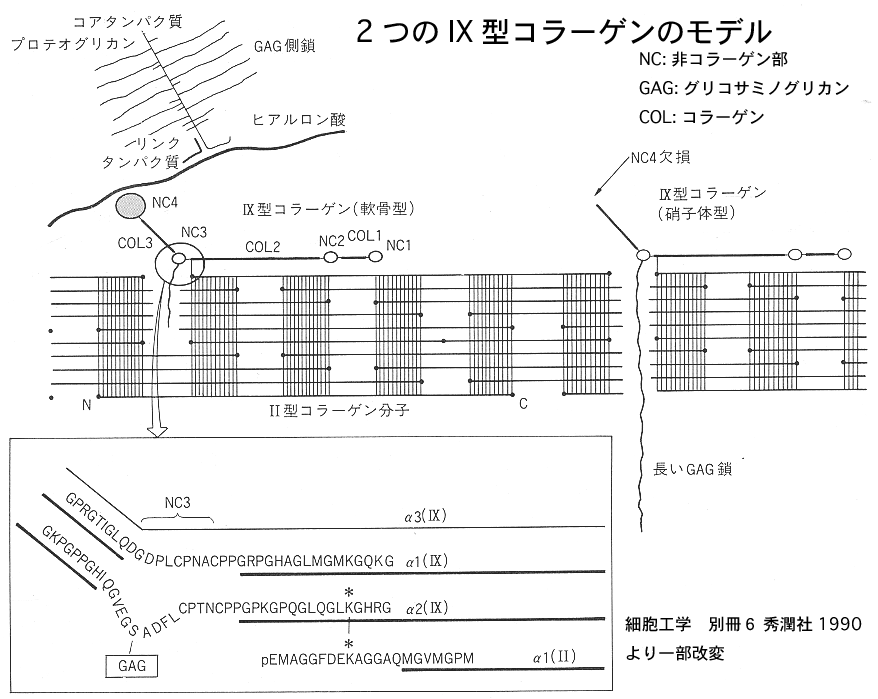
コラーゲン分子には様々な型があり、分類されているTable 1。これらが種々の結合様式をもつことで結合組織のさまざまな特性を作っている。ファイブリルコラーゲンの α1 (I), α2 (I), α1 (II), α1 (III) 遺伝子突然変異が骨形成不全症、エーラス・ダンロス症候群、軟骨形成不全症で認められている 1)。短鎖コラーゲンの X 型は肥大軟骨帯に特有に観察されることから、石灰化に直接の関与はないが内軟骨性骨化過程で特別な機能をしているようだ 2)。コラーゲン分子はこのようにいくつもの型を使い分けたり、それらの型を組み合わせることで結合組織にさまざまな特性と与えている。
加えて、プロテオ グリカン(高分子糖タンパク質)と呼ばれる分子によって更なる多様性を獲得している。コラーゲンは基本的に不溶性蛋白質であることはすでに述べた。対して プロテオグリカンは、コンドロイチン硫酸、デルマタン硫酸、ヘパラン硫酸、ヘパリン、ケラタン硫酸などのグリコサミノグリカン (glycosaminoglycan)と呼ばれる硫酸化多糖が、コア[中心]タンパク core protein と呼ばれる蛋白質に共有結合してできる広義の糖タンパクであり、水分子をたくさん引きつけることができる。・・・・・以後割愛

参考文献: Marcel E. et al.: Collagen Vol. II, Biochemistry & Biomechanocs, CRC Press, Florida, p41-65, 1988. 大塚 吉兵衛ら: 医歯薬系学生のためのビジュアル生化学・分子生物学、日本医事新報社 1997年

